Información útil para el médico
sobre la Encéfalo Mielitis Diseminada Aguda
.
Los síntomas son muy diversos, pero incluyen fiebre, dolor de cabeza, vómitos, convulsiones y signos neurológicos focales. Los criterios diagnósticos están bien establecidos en niños, pero no en adultos. Las imágenes de resonancia magnética (RM) son extremadamente importantes para el diagnóstico ya que suelen ser muy caracteristicas y con patrones diferentes de otras enfermedades desmielinizantes como Esclerosis Multiple o Neuromielitis optica. El tratamiento se basa en esteroides y el pronóstico puede no ser bueno en adultos a diferencia de los niños.
Se caracteriza por un episodio agudo de encefalitis, con inflamación del SNC sintomática difusa o multifocal, que puede estar acompañada de neuritis óptica o mielitis transversa [1]. Típicamente es un episodio monofásico, pero no siempre, y a veces puede ser recurrente aun que esto es muy raro. Si ADEM es secundaria a una vacunación, también se conoce como encefalomielitis posvacunal [1-3]. También se ha relacionado con otras enfermedades autoinmunes, como el síndrome de Guillain Barré, la encefalitis de Bickerstaff, la esclerosis múltiple y los trastornos del espectro óptico de neuromielitis (NMOSD) [4].
ADEM es más común en niños que en adultos y tiene prevalencia baja de 0,4 y 0,9 / 100.000 habitantes en menores de 18 años, es menos frecuente en mayores de 18 años, pero se desconoce el número exacto [2, 4, 5]. Recientemente, existen varios casos de ADEM en adultos reportados en la literatura [6-13], probablemente porque han existido epidemias de enfermedades virales como influenza o chinkungunya, o la aplicación de vacunas en adultos (influenza o hepatitis).
EMDA es consecuencia de la introducción de biopartículas que generan una reacción inmunológica falsa. En los niños, en la mayoría de los casos están involucrados los agentes infecciosos de sarampión, herpes, varicela, paperas, Epstein-Barr o gripe. Sin embargo, en adultos, uno de los agentes más frecuentes es la Influenza, pero cualquier virus o bacteria puede participar en el desarrollo de ADEM. Especialmente en adultos, muchas veces el agente no se identifica. También las vacunas y otros factores iatrogénicos (fármacos naturales) pueden inducir ADEM [3, 14-16]. Algunos autores han propuesto una predisposición a desarrollar ADEM asociada a la expresión de los alelos HLADQB1-0602-1501 y DRDI-1503 [15].
Hoy en día, desconocemos el mecanismo biológico exacto involucrado en la enfermedad ADEM. Sin embargo, la alta respuesta clínica a los esteroides y el antecedente de la aplicación de la vacuna o un evento infeccioso previo nos lleva a pensar que los procesos autoinmunes e inflamatorios son los componentes principalespara el desarrollo de esta enfermedad. Una de las teorías más fuertes propone un mecanismo de mimetismo molecular. Este proceso autoinmune genera inflamación, desmielinización, lesión axonal y edema [17].
La mímetización molecular consiste en que las partículas de reacción cruzada (epítopos) de los antígenos extraños (virus, bacterias, etc.), que se presentan a las células T o B a través del complejo principal de histocompatibilidad (MHC), producen la activación de las células T CD4 + o CD8 + y la liberación de múltiples citocinas proinflamatorias como el interferón tipo I (IFN), interleucina (IL) -1β, IL-12, IFNγ, IL-17 y factor de necrosis tumoral α, anticuerpos y células citotóxicas [18].
Los hallazgos patológicos macroscópicos son edema y halos perivasculares de infiltrados inflamatorios microscópicos que rodean los vasos. El sello microscópico de ADEM es un patrón perivenular de una infiltración de macrófagos llamada “mangas de desmielinización”. Estas lesiones ocurren predominantemente en la materia blanca, pero también se ven en la sustancia gris. Incluso un infiltrado meníngeo linfocítico y una capa subpial de microglial pueden estar presentes [19].
El proceso inflamatorio en ADEM puede volverse tan agresivo, causando hemorragia cerebral aguda y muerte. A nivel microscópico, las hemorragias petequiales y la necrosis venular son típicas.
Los síntomas aparecen de 4 días a dos semanas después de la infección o la administración de la vacuna, pero también han reportado casos hasta 6 a 8 semanas [20]. Inicialmente, el paciente tiene fiebre, dolor de cabeza y vómitos como síntomas inespecíficos [21]. Después de algunas horas o días, se desarrolla una somnolencia, que a veces conduce a un estado comatoso, convulsiones y signos neurológicos focales, como paresias de extremidades, trastornos del habla y temblor. El proceso puede ser mortal en unos pocos días o semanas hasta en un 10% a 15% de los casos [3, 15].
La condición neurológica aparece más tarde, puede ser muy variable porque depende de la ubicación de la lesión en el SNC. Las manifestaciones más comunes son encefalopatía (41-83%), síndrome piramidal (60-95%), ataxia (18-65%) mononeuropatía craneal múltiple (22-45%), neuritis óptica (7-23%), convulsiones (13-35%), mielitis (24%), afasia (5-21%) y síndrome sensorial (2-3%) [21]. Cuando la lesión involucra el tronco encefálico, el paciente puede sufrir dificultad respiratoria e incluso coma [22]. Pueden aparecer síndromes extrapiramidales como temblor, corea, distonía o rigidez, aunque solo esporádicamente. Después de la fase aguda y sin ninguna relación con la intensidad del síndrome neurológico, puede seguir un retroceso significativo de la enfermedad [1]. Una forma hagresiva de ADEM está asociada a la sepsis causada por bacterias Gram negativas y también se observó un shock endotóxico con insuficiencia renal [15, 23]. Incluso todos estos datos están en niños, hay varios informes de casos de comportamiento clínico en adultos.
Los criterios de consenso recientes siguen siendo imperfectos y no pueden distinguir entre pacientes que tendrán una forma monofásica de enfermedad o aquellos que tendrán episodios recurrentes y multifásicos de ADEM, y aún persisten controversias sobre si ocurren recaídas en ADEM. Para el diagnóstico de ADEM debe haber características clínicas que incluyen encefalopatía difusa, y esto puede ir acompañado de neuritis óptica, mielitis transversa, convulsiones o coma. Las características radiológicas incluyen lesiones extensas de la sustancia blanca, lesiones grandes múltiples o simples, generalmente bilaterales y pueden ir acompañadas de afectación de la materia gris. Las lecciones pueden incluir anormalidades cerebrales, cerebelosas y de los ganglios basales [1].
Las definiciones internacionales de consenso del grupo de estudio de EM pediátrica para ADEM, publicado en 2007 [24] pueden ayudarnos a diferenciar las formas de encefalomielitis (Tabla 1). Se han utilizado los mismos criterios en adultos, pero es imprescindible la creación de criterios específicos para ellos.
La resonancia magnética (MRI) siempre se indica en la investigación de cualquier caso sospechoso de ADEM. Las alteraciones típicas que se muestran en la resonancia magnética son lesiones desmielinizantes hiperintensas T2 / FLAIR que pueden comprender la sustancia blanca subcortical y yuxtacortical, así como la materia gris (corteza o ganglios basales) y las estructuras infratentoriales (cerebelo, tronco encefálico o médula espinal). Las lesiones típicas de ADEM son redondas, mal definidas, bilaterales, asimétricas, grandes (incluso tumefactivas) y pueden romper la barrera hematoencefálica (es decir, lesiones que mejoran el gadolinio) [25].
Las características de resonancia magnética atípica de ADEM incluyen más de uno de los siguientes: lesiones en una sola área anatómica, lesiones bien definidas, afectación difusa de la sustancia blanca sin lesiones claras, lesiones T1-hipointensas (“agujeros negros”), lesiones predominantemente pequeñas (menores de 2 cm), lesiones periventriculares, lesiones perpendiculares al cuerpo calloso o lesiones corticales [26]. Estas características posteriores se han descrito como parte de lesiones ADEM similares a la esclerosis múltiple. De hecho, hasta el 52% de los pacientes con ADEM pueden cumplir los criterios diagnósticos de IRM para la EM. El cumplimiento de los criterios de diagnóstico de MS McDonald y los criterios de Barkhof se ha informado como un factor de riesgo de conversión a EM [27].
Estas anomalías de IRM reflejan la forma más común de presentación de ADEM: trastornos monofásicos y multifocales que representan un “síndrome polifocal clínicamente aislado” [28]. Reflejando también la presentación clínica, las lesiones ADEM que se muestran en la RM desaparecen en la mayoría de los pacientes en menos de 1 año. Se ha informado que las lesiones periventriculares son las últimas en desaparecer [29].
En caso de duda, especialmente cuando se considera un diagnóstico diferencial de tumor del SNC, las secuencias de resonancia magnética no convencionales pueden ser útiles. La espectroscopía puede mostrar hallazgos consistentes con inflamación y destrucción de tejidos (bajo N-acetil-aspartato). Se ha demostrado que una pérdida irreversible de tejido (y función) se correlaciona con una señal de NAA persistentemente baja [29]. Durante la fase aguda, las lesiones ADEM pueden mostrar restricción de difusión y los estudios SPECT pueden mostrar hipoperfusión [15].
Estudios de LCR
El LCR en un episodio agudo de ADEM puede mostrar signos de inflamación con pleocitosis y proteínas elevadas. Aunque no se miden rutinariamente, los niveles de citocinas asociadas con la activación de macrófagos y linfocitos T de neutrófilos, como CXCL1, CXCL7, CCL22 y CCL17, son más altos en los casos de EMDA en comparación con la EM [30]. Las bandas oligoclonales (BOC) son comúnmente negativas en los casos típicos de ADEM. Cuando son positivos, la mayoría de las veces se vuelven negativos cuando el síndrome mejora [31]. El hallazgo de bandas oligoclonales y un índice de IgG elevado se ha demostrado en varios estudios para elevar el riesgo de conversión a una enfermedad desmielinizante recurrente del SNC como la EM [28]. Además, algunos hallazgos en el patrón de BOC se han asociado con mayor frecuencia a la EM en comparación con EMDA, especialmente el hallazgo de BOC puramente intratecal (10% de ADEM versus 89% de EM). Un patrón espejo de BOC presente en suero y LCR o BOC negativo son los hallazgos más comunes en ADEM (10% de casos de EM, 84% de EMDA), lo que sugiere un proceso de activación inmunitaria predominantemente sistémico [30].
La búsqueda de biomarcadores que pueden ser útiles para predecir el curso de EMDA está en curso. Recientemente, se ha informado que los anticuerpos IgG en suero contra la glucoproteína oligodendrocítica de mielina (MOG) pueden estar presentes en hasta el 40% de los niños con EMDA. En los casos típicos de EMDA monofásico, estos anticuerpos se vuelven indetectables después de que la enfermedad se ha resuelto [26], en contraste con los casos de EM pediátrica en los que los títulos de los anticuerpos MOG fluctúan con la actividad de la enfermedad [32]. De hecho, los anticuerpos anti-MOG se han demostrado en diversas enfermedades desmielinizantes del SNC y, por lo general, reflejan un mejor pronóstico y una enfermedad monofásica, como en el caso de la neuritis óptica aislada [33].
Los niveles de LCR de la proteína Tau asociada a microtúbulos fosforilados, localizados principalmente en axones, están elevados en una amplia gama de enfermedades del SNC. Este también ha sido el caso con EMDA, en el que los niveles de proteína tau fueron más altos en comparación con los controles. En el seguimiento, una peor recuperación de los niveles de tau se correlacionó con una resolución incompleta de la lesión, probablemente en relación con una disrupción axonal más grave [34].
La biopsia de Brian está indicada cuando la sospecha de infección del SNC o tumor cerebral (astrocitoma, metástasis, linfoma) es fuerte o en casos en que la presentación clínica es atípica de ADEM, especialmente en casos en los que la respuesta al tratamiento estándar (es decir, esteroides, plasmaféresis e inmunoglobulina intravenosa) no es satisfactoria [35]. Las lesiones EMDA típicas muestran inflamación perivenular y subependimaria difusa y desmielinización con daño axonal generalmente leve [15].
El principal diagnóstico diferencial de EMDA es con otras enfermedades desmielinizantes autoinmunes del sistema nervioso central, como la EM y la neuromielitis óptica (NMO). La EM tumefactiva puede simular EMDA. Más recientemente, y el síndrome cerebral similar a EMDA se ha incluido como parte del espectro de enfermedades asociadas a NMO [36]. En caso de duda, se debe estudiar la presencia de anticuerpos anti-acuaporina 4 (NMO-IgG).
Se ha demostrado que otras enfermedades autoinmunes, como el lupus eritematosis sistémico y el síndrome antifosfolípido, imitan enfermedades desmielinizantes primarias [37]. Por lo tanto, una historia clínica completa y un examen general son obligatorios para identificar otros hallazgos que puedan sugerir un proceso autoinmune sistémico. La búsqueda de artritis, lesiones cutáneas sugestivas de vasculitis y hallazgos de laboratorio, como citopenias o proteinuria, es crucial y, cuando es sugestivo, la búsqueda de anticuerpos específicos (antinuclear, anti-ADN, anticardiolipina, anti-beta-2 glucoproteína) es recomendado.
Los tumores primarios (astrocitoma, linfoma) y metastásicos del SNC pueden considerarse en casos en los que la presentación o la respuesta clínica son atípicas. La mayoría de las lesiones de EMDA son supratentoriales y multifocales, que son localizaciones inusuales para los tumores del SNC en niños, el principal grupo de pacientes que desarrollan EMDA. En caso de duda, se puede considerar una biopsia cerebral.
Las infecciones del SNC pueden simular EMDA. Si el LCR no es contributivo, se puede considerar una biopsia cerebral. Las infecciones del SNC que pueden producir lesiones similares a EMDA similares con mayor frecuencia son tuberculosis, nocardiosis, infecciones fúngicas crónicas y toxoplasmosis, entre otras. Estas infecciones son más comunes en pacientes inmunodeprimidos. Se recomienda un umbral inferior para la biopsia cerebral en tales pacientes. Las bandas oligoclonales y la búsqueda de anticuerpos versus mielina (por ejemplo, anticuerpos anti-MOG) pueden ayudar a diferenciar entre las enfermedades autoinmunes e infecciosas del SNC [32].
EMDA, así como la panencefalitis esclerosante subaguda (SSPE), se consideran enfermedades posinfecciosas. En el caso de SSPE, esto se debe a una infección persistente en el SNC. En algunos casos, especialmente cuando el intervalo entre la vacunación y la enfermedad del SNC es relativamente corto, se debe considerar un diagnóstico diferencial con SSPE. Estos pacientes también muestran hallazgos polisintomáticos del SNC con una afección de conducta predominante, que imita la encefalopatía asociada a ADEM habitual [38].
El tratamiento de EMDA no se ha estudiado sistemáticamente con ensayos aleatorizados y controlados y no existe una terapia estándar. La mayoría de los datos que describen el tratamiento para EMDAse derivan de informes de casos y pequeñas series.
Los tratamientos que se utilizan son similares a los que se usan en la esclerosis múltiple (EM) y otras enfermedades autoinmunes, como los esteroides, la inmunoglobulina IV (IgIV) o la plasmaféresis [24, 39].
El primer informe que describe el tratamiento con esteroides para EMDA se publicó en 1953 con ACTH. Informes posteriores en la era anterior a la RM describieron el uso de prednisona, corticotropina y dexametasona con una marcada mejoría de los síntomas tanto en adultos como en pacientes pediátricos. Los esteroides son el tratamiento inicial más ampliamente reportado en EMDA, típicamente en dosis altas, ha habido una gran variedad en las formulaciones específicas, vías de administración, dosificación y regímenes de disminución gradual.
El fármaco de primera línea es metilprednisolona IV (10 a 30 mg / kg / día hasta una dosis máxima de 1 g / día) durante 3 a 5 días, seguido de reducción gradual de los esteroides orales durante 4 a 6 semanas con una recuperación completa informada en 50-80% de pacientes, otra opción es la dexametasona (1 mg / kg) pero en la única comparación de regímenes de corticosteroides específicos, los pacientes tratados con metilprednisolona tuvieron un resultado significativamente mejor con respecto a las puntuaciones de EDSS en comparación con los tratados con dexametasona IV [40].
Hay algunos efectos secundarios que deben considerarse con dosis altas de metilprednisolona, como hiperglucemia, hipocalemia, perforación gástrica, presión arterial alta, enrojecimiento facial y trastornos del estado de ánimo [40].
Si las dosis altas de esteroides fallan, la siguiente opción puede ser el intercambio plasmático o plasmaferesis (Plex) si la instalación tiene todos los recursos disponibles, como personal capacitado con equipo especializado y acceso venoso central para múltiples tratamientos durante un período de días a semanas. El uso de plex en EMDA se ha informado en solo un pequeño número de casos, generalmente casos graves cuando fallaron los esteroides. En uno de estos informes, los autores revisaron 59 pacientes tratados con EP por ataques agudos y severos de desmielinización del SNC, de estos pacientes 10 tenían EMDA y encontraron que el 40% de estos pacientes tenían una mejora moderada a marcada después del intercambio de plasma. En esta cohorte se realizó un número medio de siete intercambios (rango 2 a 20) [24, 40, 41]. En otro estudio donde se usó Plex en pacientes con déficit neurológicos agudos severos causados por EM u otra enfermedad inflamatoria desmielinizante del sistema nervioso central que no se recuperaron después del tratamiento con dosis altas de esteroides, los resultados mostraron que la EP conduce a una recuperación neurológica funcionalmente importante en una proporción importante de pacientes con discapacidad grave [42].
Se ha demostrado que la aplicacion de de 4-6 sesiones de Plex se asocia con una mejora moderada a marcada y sostenida. Uno podría eliminar un gran volumen de plasma por intercambio si no hay problemas de disfunción autonómica.
La Plex puede servir para eliminar los autoanticuerpos que probablemente desencadenan la desmielinización en ADEM, pero también puede cambiar la dinámica de la interacción de las células B y T dentro del sistema inmune.
Existe evidencia de las revisiones de casos de que la Plex puede ser más efectiva cuando se administra temprano en el curso de la enfermedad. Los efectos secundarios que se pueden observar son hipotensión sintomática, anemia severa y trombocitopenia asociada a heparina. El uso de Plex en EMDA necesita más investigación en este momento puede usarse como terapia de rescate cuando otras modalidades fallaron [24, 40].
Existen múltiples informes de casos de uso de IgIV con éxito solo o en combinación con corticosteroides en casos pediátricos y adultos de EMDA. En ausencia de ensayos controlados aleatorios y con la evidencia disponible, ya sea el intercambio de plasma o la IgIV, podría ser el tratamiento de segunda línea cuando fallan los corticosteroides.
Algunos estudios han reflejado una mejoría clínica después de la IgIV, especialmente cuando se identifica un desencadenante infeccioso [10]. La mejoría clínica después de la administración de IgIV se puede ver desde el curso inicial hasta 3 semanas. La dosis comúnmente utilizada es 0.4 mg / kg / día durante 5 días. En general es bien tolerado y puede usarse en casos refractarios.
Estas opciones terapéuticas se han utilizado individualmente o en combinación. Otros agentes inmunomoduladores como ciclofosfamida y rituximab se han utilizado en el tratamiento de otras enfermedades desmielinizantes fulminantes [10, 43].
Otras medidas no farmacológicas como la hemicraniectomía descompresiva y la hipotermia se han informado en casos fulminantes [10, 44].
Algunos de estos pacientes pueden necesitar atención de apoyo que incluya protección de las vías respiratorias en pacientes con estado mental alterado y ventilación mecánica si es necesario. Otras acciones de apoyo pueden incluir medicamentos anticonvulsivos, corrección de alteraciones de líquidos y electrolitos y profilaxis antitrombótica [40].
EMDA puede comportarse como una enfermedad desmielinizante fulminante, particularmente la variante hemorrágica, con un mal pronóstico [45]. La mortalidad informada en EMDA fue del 20% en estos casos [40]. Los niños tienen un buen pronóstico con una recuperación completa en un 50% a 75%, en un período de 1 a 6 meses [46], excepto en el caso de EMDA post-sarampión [40]. En adultos, la frecuencia de secuelas no está bien establecida, pero no es una sorpresa encontrar una discapacidad mayor que en niños. Los trastornos cognitivos y motores son los síntomas más comunes, sin embargo, hay algunos festejos especiales de discapacidad en adultos como movimientos involuntarios, bradicinesia y rigidez, debido a la afección de los ganglios basales. [47] Algunos autores han asociado un pronóstico desfavorable a: aparición repentina, alta severidad de los síntomas neurológicos, falta de respuesta al tratamiento con esteroides, edad avanzada y género femenino [46].
[1] D. M. Wingerchuk and B. G. Weinshenker, “Acute disseminated encephalomyelitis, transverse myelitis, and neuromyelitis optica,” Continuum (Minneap Minn), vol. 19, pp. 944-67, Aug 2013.
[2] A. Madrid Rodriguez, J. M. Ramos Fernandez, R. Calvo Medina, and J. Martinez Anton, “[Acute disseminated encephalomyelitis: epidemiological, clinical, and outcome analysis in 16 patients],” An Pediatr (Barc), vol. 80, pp. 165-72, Mar 2014.
[3] I. Steiner and P. G. Kennedy, “Acute disseminated encephalomyelitis: current knowledge and open questions,” J Neurovirol, vol. 21, pp. 473-9, Oct 2015.
[4] LeakeJAD, AlbaniS, and KaoAS, “Acute disseminated encephalomyelitis in childhood: epidemiologic, clinical and laboratory features,” Pediatr Infect Dis J, vol. 23, pp. 756-764, 2004.
[5] B. Banwell, J. Kennedy, D. Sadovnick, D. L. Arnold, S. Magalhaes, K. Wambera, et al., “Incidence of acquired demyelination of the CNS in Canadian children,” Neurology, vol. 72, pp. 232-9, Jan 20 2009.
[6] N. Mahdi, P. A. Abdelmalik, M. Curtis, and B. Bar, “A Case of Acute Disseminated Encephalomyelitis in a Middle-Aged Adult,” Case Rep Neurol Med, vol. 2015, p. 601706, 2015.
[7] J. F. Munoz Zuniga, J. Ramirez-Bermudez, J. Flores Rivera Jde, and T. Corona, “Catatonia and kluver-bucy syndrome in a patient with acute disseminated encephalomyelitis,” J Neuropsychiatry Clin Neurosci, vol. 27, pp. e161-2, 2015.
[8] Y. Kato, T. Hayashi, A. Uchino, I. Deguchi, and N. Tanahashi, “Parainfectious encephalomyeloradiculitis associated with bacterial meningitis: a case report,” J Med Case Rep, vol. 9, p. 35, 2015.
[9] E. K. Holder, J. C. McCall, and K. J. Feeko, “Acute Disseminated Encephalomyelitis in an Adult: An Uncommon Case of Paroxysmal Sympathetic Hyperactivity,” PM R, vol. 7, pp. 781-4, Jul 2015.
[10] F. Rodriguez-Porcel, A. Hornik, J. Rosenblum, E. Borys, and J. Biller, “Refractory Fulminant Acute Disseminated Encephalomyelitis (ADEM) in an Adult,” Front Neurol, vol. 5, p. 270, 2014.
[11] C. E. Otten and C. J. Creutzfeldt, “Fulminant acute disseminated encephalomyelitis presenting in an adult,” JAMA Neurol, vol. 71, pp. 648-9, May 2014.
[12] P. Maity, P. Roy, A. Basu, B. Das, and U. S. Ghosh, “A case of ADEM following Chikungunya fever,” J Assoc Physicians India, vol. 62, pp. 441-2, May 2014.
[13] A. K. Musthafa, P. Abdurahiman, and J. Jose, “Case of ADEM following Chikungunya fever,” J Assoc Physicians India, vol. 56, p. 473, Jun 2008.
[14] S. D. Andrade, M. G. Andrade, P. J. Santos, L. Galvao Mde, M. M. Barros, R. Ramasawmy, et al., “Acute disseminated encephalomyelitis following inactivated influenza vaccination in the Brazilian Amazon: a case report,” Rev Soc Bras Med Trop, vol. 48, pp. 498-500, Jul-Aug 2015.
[15] WenderM, “Acute disseminated encephalomyelitis (ADEM) “ Journal of Neuroimmunology, vol. 231, pp. 92-99, 2011.
[16] A. Shoamanesh and A. Traboulsee, “Acute disseminated encephalomyelitis following influenza vaccination,” Vaccine, vol. 29, pp. 8182-5, Oct 26 2011.
[17] S. Esposito, G. M. Di Pietro, B. Madini, M. V. Mastrolia, and D. Rigante, “A spectrum of inflammation and demyelination in acute disseminated encephalomyelitis (ADEM) of children,” Autoimmun Rev, vol. 14, pp. 923-9, Oct 2015.
[18] M. F. Cusick, J. E. Libbey, and R. S. Fujinami, “Molecular mimicry as a mechanism of autoimmune disease,” Clin Rev Allergy Immunol, vol. 42, pp. 102-11, Feb 2012.
[19] C. Lucchinetti, “Pathological heterogeneity of idiopathic central nervous system inflammatory demyelinating disorders,” Curr Top Microbiol Immunol, vol. 318, pp. 19-43, 2008.
[20] Reig-SáenzR, Zazo-SantidriánC, Martín-MedinaP, Feliú-ReyE, Díaz-BarrancoM, and Plumed-MartínL, “Clinical outcome of the hyperacute form of acute disseminated encephalomyelitis],” An Pediatr (Barc), vol. 78, pp. 234-40, 2013.
[21] HynsonJL, KornbergAJ, and ColemanLT, “Clinical and neuroradiologic features of acute disseminated encephalomyelitis in children,” Neurology, vol. 56, pp. 1308-1312, 2001.
[22] AlperG, SreedherG, and ZuccoliG, “Isolated brain stem lesion in children: is it acute disseminated encephalomyelitis or not?,” Am J Neuroradio, vol. 34, pp. 217-20, 2013.
[23] J. F. Rivera., Y. Rito., K. Casares., and M. L. Tena-Suck., “Spinal ascendant necrosis with endotoxin shock associated to staphylococcus Aureus – case report,” Case Reports in Clinical Pathology, vol. 2, 2015.
[24] L. B. Krupp, B. Banwell, and S. Tenembaum, “Consensus definitions proposed for pediatric multiple sclerosis and related disorders,” Neurology, vol. 68, pp. S7-12, Apr 17 2007.
[25] A. F. Elhassanien and H. A. Aziz, “Acute demyelinating encephalomyelitis: Clinical characteristics and outcome,” J Pediatr Neurosci, vol. 8, pp. 26-30, Jan 2013.
[26] M. Baumann, K. Sahin, C. Lechner, E. M. Hennes, K. Schanda, S. Mader, et al., “Clinical and neuroradiological differences of paediatric acute disseminating encephalomyelitis with and without antibodies to the myelin oligodendrocyte glycoprotein,” J Neurol Neurosurg Psychiatry, vol. 86, pp. 265-72, Mar 2015.
[27] M. F. Liao, C. C. Huang, R. K. Lyu, C. M. Chen, H. S. Chang, C. C. Chu, et al., “Acute disseminated encephalomyelitis that meets modified McDonald criteria for dissemination in space is associated with a high probability of conversion to multiple sclerosis in Taiwanese patients,” Eur J Neurol, vol. 18, pp. 252-9, Feb 2011.
[28] R. F. Neuteboom, M. Boon, C. E. Catsman Berrevoets, J. S. Vles, R. H. Gooskens, H. Stroink, et al., “Prognostic factors after a first attack of inflammatory CNS demyelination in children,” Neurology, vol. 71, pp. 967-73, Sep 23 2008.
[29] B. Anlar, K. Karli-Oguz, O. Y. Yurtyapan, N. Senbil, O. Herguner, S. Altunbasak, et al., “Tracing immature myelin in acute disseminated encephalomyelitis,” Turk J Pediatr, vol. 48, pp. 197-201, Jul-Sep 2006.
[30] D. Franciotta, E. Zardini, S. Ravaglia, G. Piccolo, L. Andreoni, R. Bergamaschi, et al., “Cytokines and chemokines in cerebrospinal fluid and serum of adult patients with acute disseminated encephalomyelitis,” J Neurol Sci, vol. 247, pp. 202-7, Sep 25 2006.
[31] V. V. Brinar and C. M. Poser, “Disseminated encephalomyelitis in adults,” Clin Neurol Neurosurg, vol. 110, pp. 913-8, Nov 2008.
[32] T. Derfuss and E. Meinl, “Identifying autoantigens in demyelinating diseases: valuable clues to diagnosis and treatment?,” Curr Opin Neurol, vol. 25, pp. 231-8, Jun 2012.
[33] E. Martinez-Hernandez, M. Sepulveda, K. Rostasy, R. Hoftberger, F. Graus, R. J. Harvey, et al., “Antibodies to aquaporin 4, myelin-oligodendrocyte glycoprotein, and the glycine receptor alpha1 subunit in patients with isolated optic neuritis,” JAMA Neurol, vol. 72, pp. 187-93, Feb 2015.
[34] M. Oka, S. Hasegawa, T. Matsushige, H. Inoue, M. Kajimoto, N. Ishikawa, et al., “Tau protein concentrations in the cerebrospinal fluid of children with acute disseminated encephalomyelitis,” Brain Dev, vol. 36, pp. 16-20, Jan 2014.
[35] H. Koshihara, K. Oguchi, Y. Takei, K. Kitazawa, K. Higuchi, and S. Ohara, “Meningeal inflammation and demyelination in a patient clinically diagnosed with acute disseminated encephalomyelitis,” J Neurol Sci, vol. 346, pp. 323-7, Nov 15 2014.
[36] D. M. Wingerchuk, B. Banwell, J. L. Bennett, P. Cabre, W. Carroll, T. Chitnis, et al., “International consensus diagnostic criteria for neuromyelitis optica spectrum disorders,” Neurology, vol. 85, pp. 177-89, Jul 14 2015.
[37] L. Ordonez, E. Skromne, D. Ontaneda, and V. M. Rivera, “Multiphasic disseminated encephalomyelitis, systemic lupus erythematosus and antiphospholipid syndrome,” Clin Neurol Neurosurg, vol. 109, pp. 102-5, Jan 2007.
[38] S. Comert, A. Vitrinel, H. A. Gursu, N. C. Deniz, and Y. Akin, “Subacute sclerosing panencephalitis presenting as acute disseminated encephalomyelitis,” Indian J Pediatr, vol. 73, pp. 1119-21, Dec 2006.
[39] S. Schwarz, A. Mohr, M. Knauth, B. Wildemann, and B. Storch-Hagenlocher, “Acute disseminated encephalomyelitis: a follow-up study of 40 adult patients,” Neurology, vol. 56, pp. 1313-8, May 22 2001.
[40] M. Alexander and J. M. Murthy, “Acute disseminated encephalomyelitis: Treatment guidelines,” Ann Indian Acad Neurol, vol. 14, pp. S60-4, Jul 2011.
[41] S. Llufriu, J. Castillo, Y. Blanco, L. Ramio-Torrenta, J. Rio, M. Valles, et al., “Plasma exchange for acute attacks of CNS demyelination: Predictors of improvement at 6 months,” Neurology, vol. 73, pp. 949-53, Sep 22 2009.
[42] B. G. Weinshenker, “Therapeutic plasma exchange for acute inflammatory demyelinating syndromes of the central nervous system,” J Clin Apher, vol. 14, pp. 144-8, 1999.
[43] R. P. Lu and G. Keilson, “Combination regimen of methylprednisolone, IV immunoglobulin, and plasmapheresis early in the treatment of acute disseminated encephalomyelitis,” J Clin Apher, vol. 21, pp. 260-5, Dec 2006.
[44] T. Takata, M. Hirakawa, M. Sakurai, and I. Kanazawa, “Fulminant form of acute disseminated encephalomyelitis: successful treatment with hypothermia,” J Neurol Sci, vol. 165, pp. 94-7, May 1 1999.
[45] C. J. Bevan and B. A. Cree, “Fulminant Demyelinating Diseases of the Central Nervous System,” Semin Neurol, vol. 35, pp. 656-66, Dec 2015.
[46] T. Menge, B. C. Kieseier, S. Nessler, B. Hemmer, H. P. Hartung, and O. Stuve, “Acute disseminated encephalomyelitis: an acute hit against the brain,” Curr Opin Neurol, vol. 20, pp. 247-54, Jun 2007.
[47] J. Tomas, M. C. Macario, E. Gaspar, and I. Santana, “Severe post-influenza (H1N1) encephalitis involving pulvinar nuclei in an adult patient,” BMJ Case Rep, vol. 2015, 2015.
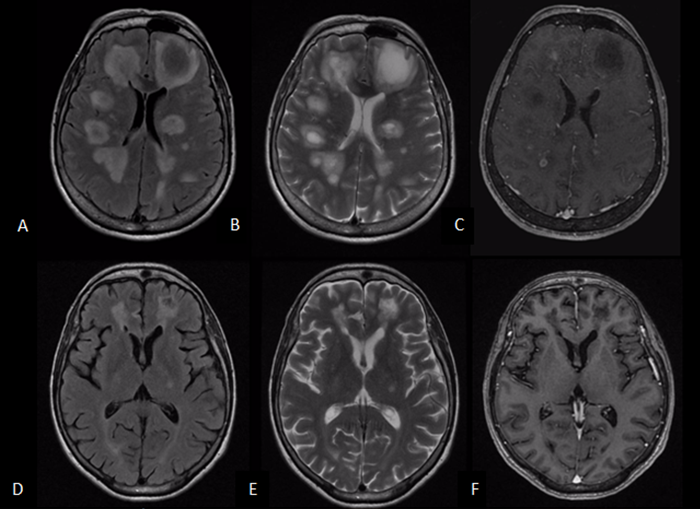
A,B) RM T2/FLAIR: lesiones desmielinizantes hiperintensas múltiples que comprometen la sustancia blanca y la materia gris.
C) T1C lesiones con realce de anillo.
D, E) T2 / FLAIR disminución de las lesiones después de tratamiento 8 meses después.
F) T1C sin lesiones activas después de tratamiento.





